Links
- Manfred von Mackensen:
Wie wirken atomistische Modellvorstellungen auf das Naturverständnis des jungen Menschen?Erziehungskunst 01/1980, S. 18-38
- Peter Buck:
Zur Didaktik des AtombegriffsVerhärtetes wieder flüssig machen.
Erziehungskunst 10/1980, S. 589-599 - Rudolf Steiner (1882):
Einzig mögliche Kritik der atomistischen Begriffeanthroposophie.net
- Wolfgang Schad:
Zum Chemie-Unterricht in der WaldorfschuleErziehungskunst 03/1998, S. 264-277
- Telekolleg Chemie 1 - Atommodelle
Eine schon etwas ältere TV-Sendung vom Bayerischen Rundfunk, die sehr verständlich und informativ ist. Unbedingt anschauen!
- Telekolleg Chemie 2 - Atombau und Periodensystem
Fortsetzung der Sendung von oben.
Unbedingt anschauen! - Die „Welt der Atome“
- Atommodelle
Gute Darstellung von U. Helmich
- Entwicklung der Atomvorstellung
Aus der Physik des Rupprecht-Gymnasiums in München.
Aufbruch in die atomare Dimension
ZDFStudienprogramm Chemie 1973 Folge 2
Quelle: YouTube-Video von zeltersee01 • 04.09.2011
Elektronen – Wolken, die die Atome verbinden
ZDFStudienprogramm Chemie 1973 Folge 5
Quelle: YouTube-Video von zeltersee01 • 12.04.2010
Atommodelle
Ein Atommodell ist eine Vorstellung von den kleinsten Teilen der Stoffe. Lange Zeit gab es keine experimentellen Hinweise für die Existenz kleinster Teilchen, sondern lediglich die intuitive Ablehnung unendlich fortsetzbarer Teilbarkeit, sowie die Möglichkeit, die vielfältigen Eigenschaften von Materialien und Substanzen auf kleinste Teilchen geringerer Zahl zurückzuführen. Grundlage der Modelle der Neuzeit sind beobachtbare Eigenschaften der Materie und experimentell ermittelte Daten.
Auf die Frage, wie man sich denn ein Atom nun vorzustellen habe, antwortete der Physiker Werner Heisenberg: „Versuchen Sie es gar nicht erst!“ Die Formulierung der gängigen Atommodelle der Quantenmechanik bestehen vorrangig aus mathematischen Aussagen.
Quelle: Wikipedia: Liste der Atommodelle
Hans-Peter Dürr – Das Geistige ist die treibende Kraft
Quelle: YouTube-Video von profgertler • hochgeladen am 11.05.2013
Der Quantenphysiker Hans-Peter Dürr im Gespräch. Die Themenbereiche: „Wir müssen die Wirklichkeit total anders sehen.“ / Der Urknall / Die Naturgesetze / Entstehung des Lebens / Evolution / Das Geistige als treibende Kraft / Die „Wirklichkeit“ des Naturwissenschaftlers / Sternenstaub und Schaumkämme. Aufgenommen im Max-Planck-Institut München, Sommer 1997.
Im Grunde gibt es Materie gar nicht. Jedenfalls nicht im geläufigen Sinne. Es gibt nur ein Beziehungsgefüge, ständigen Wandel, Lebendigkeit. Wir tun uns schwer, uns dies vorzustellen. Primär existiert nur Zusammenhang, das Verbindende ohne materielle Grundlage. Wir könnten es auch Geist nennen. Etwas, was wir nur spontan erleben und nicht greifen können.“Das Atom - John Dalton und Niels Bohr
Quelle: YouTube-Video von Dorian Rändler
Die Sendungen der Reihe stellen in informativer und unterhaltender Form herausragende Leistungen und Erfindungen der technischen und naturwissenschaftlichen Entwicklung vor. Angereichert mit Anekdoten werden technische und physikalische Hintergründe durch Animationen und geschichtliche Materialen anschaulich erklärt.
Eine nette Anekdote über Niels Bohr| Quelle: Die folgenden Texte sind aus: „Der Atombau“ von Ulrich Helmich |
Sir Joseph John Thomson (* 18.12.1856 in Cheetham Hill bei Manchester; † 30. 08.1940 in Cambridge) war ein britischer Physiker, Nobelpreisträger und Entdecker des Elektrons (1897).
Quelle: Wikipedia / J. J. Thomson
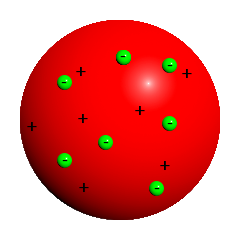
Thomsonsches „Rosinenkuchenmodell“
Quelle: Wikipedia / Thomsonsches Atommodell

Ernest Rutherford (* 30.08.1871 Neuseeland; † 19.10.1937 Cambridge). Neuseeländischer Atomphysiker, der 1908 den Nobelpreis für Chemie erhielt.
Quelle: Wikipedia / E. Rutherford
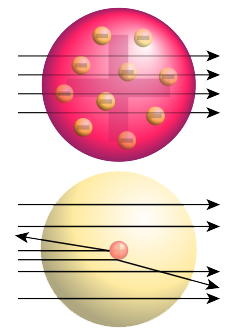
oben: erwartetes Ergebnis nach dem Thomsonschen Atommodell; unten: beobachtetes Ergebnis
Quelle: Wikipedia / Rutherford-Streuung
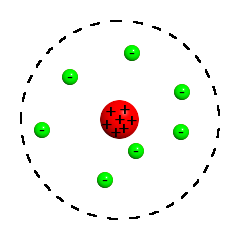
Kern-Hülle-Modell nach Rutherford
Quelle: Wikipedia / Rutherfordsches Atommodell
Das Rosinenkuchenmodell
- Joseph John Thomson (1856-1940) – britischer Physiker, Nobelpreisträger und Entdecker des Elektrons (1897) - hat mehrere Atommodelle entworfen, das bekannteste ist das Rosinenkuchenmodell
- Danach besteht das Atom aus einer positiven Grundmasse, in die die negativen Elektronen wie die Rosinen in einem Kuchen eingebettet sind.
- In die diffuse und elektrisch neutrale Masse sind sowohl positive wie auch negative Ladungsträge eingebettet.
- Bei einem neutralen Atom sind genau so viele positive Ladungsträger verhanden wie negative.
- Bei einem Kation sind die positiven Teilchen im Überschuss, bei einem Anion die negativen Teilchen (Elektronen).
- Atome enthalten also positive und negative Ladungen, und zwar in gleicher Zahl, so dass sie nach außen hin elektrisch neutral erscheinen.
- Bei chemischen Vorgängen können negative Ladungen (Elektronen) aufgenommen oder abgegeben werden, dabei entstehen dann Anionen bzw. Kationen.
- Die Atome in den Elementen sind grundsätzlich elektrisch neutral. Zinkatome in metallischem Zink oder Schwefelatome in reinem Schwefel tragen keine Ladungen.
- Befinden sich die Atome dagegen in chemischen Verbindungen, z.B. im Zinkbromid oder im Kochsalz, so können sie Ladungen tragen.
- Im Kochsalz tragen die Natriumatome z.B. eine positive Ladung, die Chloratome dagegen eine negative.
- Wenn wir Magnesium verbrennen, entsteht Magnesiumoxid. Die Magnesiumatome sind hier zweifach positiv geladen, und die Sauerstoffatome zweifach negativ.
- Alle Salze und salzartigen Verbindungen (Oxide, Sulfide etc.) sind aus Ionen zusammengesetzt.
- Daher leiten Salze auch den elektrischen Strom, wenn man sie schmilzt oder in Wasser auflöst.
- Aber nicht alle Verbindungen bestehen aus Ionen.
- Flüssiges Benzin z.B. leitet den Strom überhaupt nicht, weil es aus elektrisch neutralen Molekülen besteht.
Das Kern-Hülle-Modell
- England um 1910 von Ernest Rutherford (1871-1934)
- Nach Thomsons Atommodell müssten kleinste Teilchen, wenn man sie mit hoher Geschwindigkeit auf eine Schicht solcher Atome schießt, zum größten Teil geradlinig hindurchfliegen.
- Denn die positive Grundmasse ist nach Thomson relativ locker und leicht durchdringbar, während die Elektronen sehr klein sind und die hindurchfliegenden Teilchen so gut wie nicht beeinflussen dürften.
Rutherfords Streuversuch
- Er verwendete eine Goldfolie, die so dünn war, dass sie nur aus wenige Tausend Atomschichten bestand.
- Radioaktive α-Strahlen bestehen aus positiv geladenen Heliumionen und hinterlassen schwarze Flecken auf einem photographischen Film und helle Flecken auf einem Leuchtschirm. Damit kann man sie also sehr leicht nachweisen.
- Er positionierte er die Goldfolie so, dass sie der α-Strahlung ausgesetzt war. Hinter die Goldfolie und auch drumherum platzierte er einen photographischen Film, damit er sehen konnte, wo die Strahlung überall einschlug.
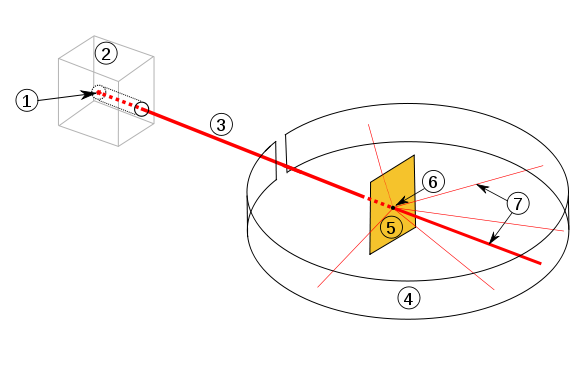
Abbildung: Der Rutherfordsche Streuversuch, schematisch dargestellt.
1: Radioaktives Radium; 2: Bleimantel zur Abschirmung; 3: α-Teilchenstrahl; 4: Leuchtschirm bzw. Fotografieschirm; 5: Goldfolie; 6: Punkt, an dem die Strahlen auf die Folie treffen; 7: Teilchenstrahl trifft den Schirm, nur wenige Teilchen werden abgelenkt.
Quelle: Wikipedia / Rutherford-Streuung
- Was erwartete Rutherford nun von dem Versuch?
- Wenn ein Atom so aufgebaut ist, wie von Thomson postuliert, dann müsste der größte Teil der Strahlung glatt durchgehen.
Und wie sah das Versuchsergebnis aus?
- Der größte Teil der α-Strahlung durchdrang wie erwartet die immerhin einige Tausend Schichten dicke Goldfolie. Direkt gegenüber dem α-Strahler konnte Rutherford die meisten Einschläge in den photographischen Film zählen. Links und rechts daneben auch einige wenige.
- Ein paar wenige α-Teilchen wurden aber abgelenkt, und ein noch kleinerer Teil wurde sogar direkt reflektiert. Und damit hat Rutherford gar nicht gerechnet.
- Das heißt, irgendwo musste etwas in dem Atom sein, was in der Lage war, positive Teilchen abzulenken oder sogar zu reflektieren. Und dieses „irgendetwas“ musste ziemlich massiv sein, denn sonst hätte es die relativ schweren α-Teilchen gar nicht ablenken können.
- Andererseits musste dieses „irgendetwas“ auch ziemlich klein sein, denn sonst würden die meisten α-Strahlen nicht geradlinig durch die Atome fliegen.
- Nach Rutherfords Vorstellungen befand sich die gesamte positive Ladung des Atoms in einem extrem winzigen aber recht schweren Atomkern konzentriert. Die negative Ladung - in Form von Elektronen - schwirrte dagegen in der Atomhülle herum. Daher sprach man auch vom Kern-Hülle-Modell.
- Genauere Bestimmungen ergaben dann, dass der Atomkern mit einem Durchmesser von 10-14 m 10.000 mal kleiner ist als das gesamte Atom, dessen Durchmesser 10-10 m beträgt.
- Wenn der Atomkern durch einen Kirschkern dargestellt würde (Durchmesser vielleicht 1 cm), so müsste das entsprechende Atom 100 m Durchmesser haben! Der größte Teil eines Atoms ist also leer, besteht aus nichts!
- Die Versuchsergebnisse des Rutherfordschen Streuversuchs (wie der Versuch jetzt auch genannt wird) lassen sich so ganz einfach erklären.
- Die meisten Teilchen flogen einfach durch das große Atom durch, ohne dem winzigen Atomkern auch nur nahe zu kommen. Einige wenige Teilchen kamen jedoch in die Nähe des Atomkerns und wurden durch die positive Ladung mehr oder weniger stark abgelenkt. Und nur ein paar Teilchen trafen genau auf den Atomkern und prallten dort wegen der hohen Masse des Kerns ab.

Niels Bohr (1922)
Quelle: Nobel Price biography, Wikipedia
Das Schalenmodell nach Niels Bohr
- Mit dem Kern-Hülle-Modell können wir schon einige Phänomene erklären, aber längst noch nicht alle. Vor allem kann das Kern-Hülle-Modell von Rutherford nicht das chemische Verhalten der Elemente erklären: Warum sind Natrium und Kalium so äußerst reaktionsfreudig, und warum reagieren die Edelgase überhaupt nicht mit anderen Elementen oder Stoffen?
- Das Kern-Hülle-Modell muss also verändert oder erweitert werden.
Ionen und Ionisierungsenergie
- Ionen haben wir bereits kennen gelernt, nämlich bei der Elektrolyse von Zinkbromid. Mit dem Rosinenkuchenmodell konnten wir die Existenz von Ionen leicht erklären: positive Ionen haben Elektronen abgegeben, negative Ionen haben Elektronen zu viel.
- Die Energie, die man benötigt, um ein Elektron aus einem Atom zu entfernen, nennt man Ionisierungsenergie.
- Wenn man auf die rechts dargestellte Weise die ersten 20 Elemente des Periodensystems untersucht und die Ionisierungsenergien gegen die Ordnungszahl aufträgt, so erhält man folgende Grafik:
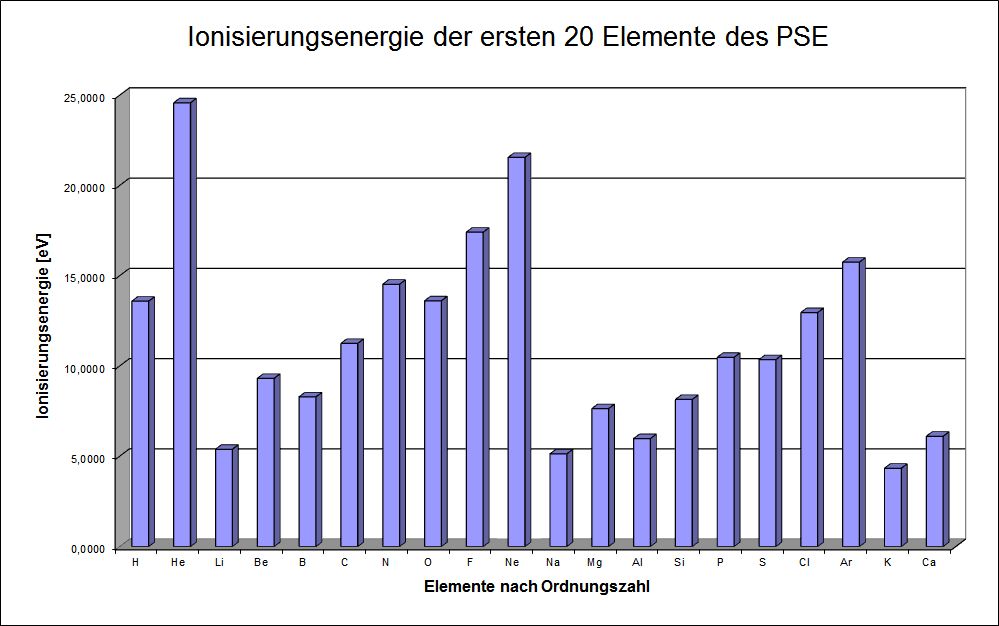
Abbildung: Ionisierungsenergien der ersten 20 Elemente (nach Ulrich Helmich)
- Hier kann man drei wichtige Beobachtungen machen:
- Innerhalb einer Periode nimmt die Ionisierungsenergie zu (z.B. vom Li zum Ne).
- Innerhalb einer Gruppe nimmt die Ionisierungsenergie ab (vgl. He, Ne und Ar).
- Beim Übergang von einer Periode zur nächsten sinkt die Ionisierungsenergie schlagartig (z.B. Übergang vom Ne zum Na).
- Wir haben hier bereits einen ersten Hinweis auf das chemische Verhalten der Elemente: die besonders reaktionsfreudigen Alkalimetalle haben alle eine sehr niedrige Ionisierungsenergie, während die extrem reaktionsträgen Edelmetalle durchweg eine sehr hohe Ionisierungsenergie haben.
Ein Erklärungsmodell
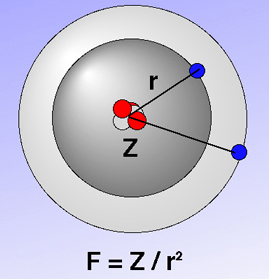
Abbildung: Modell zur Ionisierung (Quelle: Ulrich Helmich)
- Es scheint fast so, als ob reaktionsfreudige Elemente ihre Elektronen besonders leicht abgeben, während Edelgase ihre Elektronen besonders gerne behalten.
- Die Kraft, mit der die Elektronen eines Atoms angezogen werden, hängt von zwei Faktoren ab: der Kernladungszahl Z und dem Kern-Elektron-Abstand r.
- Je größer die Kernladungszahl, desto stärker wird ein Elektron angezogen, und je größer der Radius, desto weniger stark wird es angezogen (weil der Radius ja in der Formel unter dem Bruchstrich steht).
- Wie man an der Formel leicht erkennen kann, ist der Einfluss des Radius wichtiger als der Einfluss der Kernladungszahl, denn der Radius steht im Quadrat unter dem Bruchstrich: doppelter Radius = ein Viertel Anziehungskraft.
- Von der Anziehungskraft hängt die Ionisierungsenergie eines Atoms direkt ab: Je größer F, desto größer auch die Energie, die notwendig ist, um ein Elektron aus dem Atom zu entreißen.
Deutung der Beobachtungen
- Innerhalb einer Periode nimmt die Kernladungszahl der Atome zu. Dadurch steigt die Ionisierungsenergie.
- Innerhalb einer Gruppe nimmt der Abstand zwischen Kern und Elektron zu, gleichzeitig nimmt aber auch die Kernladungszahl zu. Da der Einfluss des Radius aber stärker ist (r steht zum Quadrat unter dem Bruchstrich, Z nur in der 1. Potenz), nimmt die Ionisierungsenergie innerhalb einer Gruppe von oben nach unten ab.
- Beim Übergang von einer Periode zur nächsten, z.B. beim Übergang vom Neon zum Natrium, nimmt der Abstand Kern-Elektron schlagartig zu. Es wird sozusagen eine neue Schale "aufgemacht", um das nächste Elektron unterzubringen.
- Beim Neon-Atom befinden sich zwei Elektronen auf der innersten Schale, der K-Schale, und acht Elektronen auf der zweiten Schale, der L-Schale.
- Wieso die K-Schale zwei und die L-Schale acht Elektronen fasst, geht aus den Ionisierungsenergien hervor. Der erste große Sprung tritt beim Übergang vom Helium zum Lithium auf - nach den ersten beiden Elektronen also, die untergebracht werden müssen.
- Und der zweite große Sprung tritt nach acht weiteren Elektronen auf.
- Geistreiche Frage jetzt: wie viel Elektronen passen auf die hier nicht eingezeichnete M-Schale? Natürlich auch acht Elektronen, denn der dritte Sprung in den Ionisierungsenergien tritt nach acht weiteren Elektronen auf.
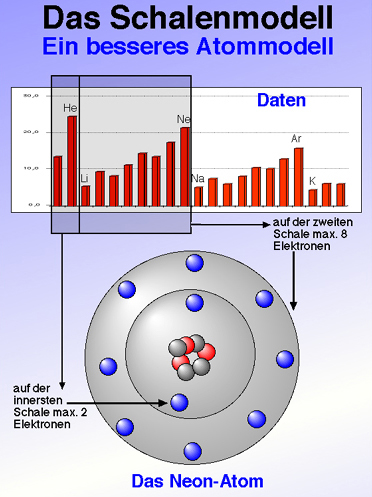
Abbildung: Das Schalenmodell (Quelle: Ulrich Helmich)
Schalenmodell
- Nach dem Schalenmodell ist Kernhülle in unterschiedliche Elektronenschalen aufgeteilt. Die innerste Schale, die K-Schale, kann maximal zwei Elektronen aufnehmen, alle anderen Schalen fassen maximal acht Elektronen.
- Schauen wir uns nun das Schwefel-Atom im Schalenmodell an:
- Die Elektronenkonfiguration ist so zu lesen: zwei Elektronen auf der K Schale, 8 auf der L-Schale und 6 auf der M-Schale.
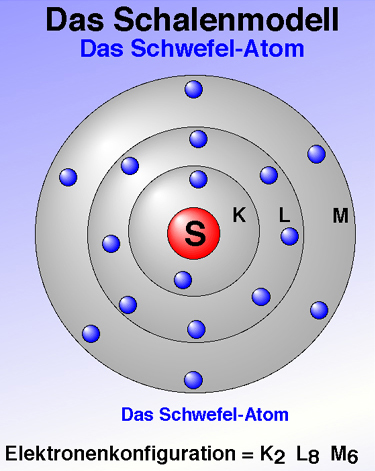
Abbildung: Schwefel-Atom gemäß Schalenmodell (Quelle: Ulrich Helmich)