Antoine Laurent de Lavoisier
(* 26.08.1743; † 8.05.1794)
Verbindungen
Verbindungen, natürlich vorkommende oder künstlich hergestellte Stoffe, die aus 2 oder mehreren Elementen bestehen. Die Atome der beteiligten Elemente vereinigen sich zu Molekülen oder Ionengittern. Im Unterschied zu Gemischen stehen die in einer Verbindung enthaltenen Elemente zueinander in gleichbleibenden Massenverhältnissen, worauf die gesamte quantitative Beschreibung chemischer Vorgänge basiert (Stöchiometrie). Verbindungen lassen sich nur durch chemische Reaktionen, nicht durch physikalische Methoden (z. B. Filtrieren, Lösen, Destillieren) in einfachere Stoffe zerlegen.
Gemische
Gemische, Vereinigungen von zwei oder mehreren verschiedenen Stoffen. Gemische haben im Unterschied zu Verbindungen keinen einheitlichen Schmelz- und Siedepunkt. Auch lassen sich die Komponenten in jedem beliebigen Verhältnis miteinander mischen, während die Bestandteile chemischer Verbindungen stets in einem konstanten Mengenverhältnis zueinander stehen. Man unterscheidet homogene Gemische (z. B. Gasgemische, Lösungen, Legierungen), bei denen alle mechanisch abtrennbaren Teile gleiche Eigenschaften aufweisen, und heterogene Gemische (z. B. Gemenge fester Stoffe, Aufschlämmungen, Suspensionen), in denen die charakteristischen Eigenschaften der Bestandteile erhalten bleiben. Homogene Gemische kann man durch Destillation, Sublimation und Kristallisation trennen, Heterogene Gemische trennt man durch Sieben, Schlämmen, Filtrieren.
Gesetze, nach denen sich die Stoffe verbinden
Einführung der chemischen Symbole
- 1813 Jöns Jakob Berzelius (schwedischer Chemiker, 1779-1848)
Gesetz von der Erhaltung der Masse
- Im Jahre 1748 fand bereits Michael Wassiljewitsch Lomonossow (1711-1765) das Gesetz von der Erhaltung der Masse.
- Dasselbe Gesetz fand u. formulierte Antoine Laurent de Lavoisier (1743-1794), als er mit Hilfe der Waage die Umsetzung von Metallen mit Luft (Sauerstoff) untersuchte. Das Hauptverdienst der damaligen Forschung lag in der Einführung der Waage beim chemischen Arbeiten.
1785 Lavoisier → Gesetz von der Erhaltung der Masse
Erstes chemisches Grundgesetz:
➞ Masse Ausgangsstoffe = Masse entstehende Stoffe
Chemische Reaktionen
Quelle: YouTube-Video von Filmsortiment • hochgeladen am 13.03.2012
Gesetz von den konstanten Proportionen
- erkannte bereits Lavoisier - fand aber zunächst keinen Widerhall
- 1799 durchgesetzt durch Josephe-Louis Proust
- und 1803 noch einmal von John Dalton

John Dalton (* 6.09.1766, † 27.07.1844)
Zweites chemisches Grundgesetz:
Natriumchlorid zum Beispiel enthält immer 40 % Natrium und 60 % Chlor.
Magnetkies (Eisensulfid) kommt immer im Verhältnis 7:4 vor.
7 Masseteile Eisen reagieren mit 4 Masseteilen Schwefel
oder: Magnetkies setzt sich immer aus 64 % Eisen und 36 % Schwefel zusammen.
Atomhypothese
- Vom dem Gesetz der konstanten Proportionen gelangte John Dalton 1807 zu seiner Atomhypothese
- Er nahm damit die Vorstellung von Demokrit, die 2.000 Jahre in Vergessenheit gelangt war, wieder auf (atomos gr = unteilbar)

Joseph-Louis Proust (1754-1826)
- Die Atome müssen eine bestimmte unveränderliche Masse besitzen, die für jedes Element charakteristisch ist.
- Das Gesetz von den konstanten Proportionen ließe sich nach Dalton kaum erklären, wenn man eine kontinuierliche, unbeschränkte Teilbarkeit der Materie annehmen würde.
- Danach lässt sich das Gesetz der konstanten Proportionen so erklären, dass sich bei der Reaktion zwischen zwei Elementen stets eine bestimmte Anzahl von Atomen zu einem Molekül vereinigen.
- Beispiele:
Wasser (H2O): 2 Moleküle Wasserstoff verbinden sich mit einem Molekül Sauerstoff zu einem Molekül Wasser: 2 H2 + O2 → 2 H2O
Oder Kochsalz: 2 Na + Cl2 → 2 NaCl
Gesetz von den multiplen Proportionen
(mehrfache Massenverhältnisse)
- Aus seiner Atomhypothese leitete John Dalton 1807 das Gesetz der multiplen Proportionen ab.
- Es gibt eine Reihe von Elementen, die mehrere Verbindungen miteinander bilden, z. B. Kohlenstoffoxide oder Eisenoxide.
- Die Zusammensetzung der Verbindungern zeigt auffallende Gesetzmäßigkeiten.
Beispiele
Reaktion von Eisen mit Schwefel
Quelle: YouTube-Video von ChemToddler • hochgeladen am 17.08.2008
| Braunes Bleioxid | 1 g Blei verbindet sich mit 0,154 g Sauerstoff |
| Gelbes Bleioxid | 1 g Blei verbindet sich mit 0,077 g Sauerstoff |
| Vergleich beider | Sauerstoffverhältnis 2:1 |
| Schwarzes Kupferoxid | 1 g Kupfer verbindet sich mit 0,252 g Sauerstoff |
| Rotes Kupferoxid | 1 g Kupfer verbindet sich mit 0,126 g Sauerstoff |
| Vergleich beider | Sauerstoffverhältnis 2:1 |
Verbindung von Eisen mit Sauerstoff | |||
|---|---|---|---|
| 1. | 56 g Eisen verbindet sich mit 16 g Sauerstoff | FeO | |
| 1 x 56 g Eisen (Fe) | 1 x 16 g Sauerstoff (O) | ||
| 2. | 112 g Eisen verbindet sich mit 48 g Sauerstoff | Fe2O3 | |
| 2 x 56 g Eisen (Fe) | 3 x 16 g Sauerstoff (O) | ||
| 3. | 168 g Eisen verbindet sich mit 64 g Sauerstoff | Fe3O4 | |
| 3 x 56 g Eisen (Fe) | 4 x 16 g Sauerstoff (O) | ||
Drittes chemisches Grundgesetz:
Gesetz von den multiplen Proportionen
Bilden zwei Elemente miteinander mehrere Verbindungen, so stehen die Massenverhältnisse, mit denen die Elemente in diesen Verbindungen auftreten, zueinander im Verhältnis kleiner ganzer Zahlen.
Beispiele:
Schwefeldioxid SO2 und Schwefeltrioxid SO3
Kohlenmonoxid CO und Kohlendioxid CO2
- Ein Atom kann sich nur mit einem oder zwei oder drei usw. Atomen eines anderen Elementes verbinden und nicht mit Bruchteilen davon.
Atommasse
- Dalton meinte man könne die unendlich kleine Masse von Atomen nicht bestimmen (die absolute Atommasse beträgt je nach Atomart 10-24 bis 10-22 Gramm)
- interessant ist also das Verhältnis der Atommassen zueinander
- Feststellung: Wasserstoff hat die kleinste Atommasse → erhält den Wert 1 und dient somit als Bezugsgröße
- willkürliche Festlegung: Atommasse H = 1 u (unit → Atommasseneinheit)
- Sauerstoff hat dann 16 u → Relative Atommasse (Massenzahl)
➞ Grammatom bzw. Grammmolekül (= Mol)
Amadeo Avogadro (* 09.08.1776, † 09.07.1856)
Volumengesetz von Gasen
- Das Volumen eines Gases ist bei gleichem Druck und gleicher Temperatur der Masse dieses Gases proportional
Satz von Avogadro
- Um das Volumengesetz von Gay-Lussac zu deuten, nahm Amadeo Avogadro (1776-1856; ital. Physiker) an, dass in gleichen Raumteilen von Gasen bei gleichen Bedingungen gleich viele Teilchen enthalten sein müssten.
In gleichen Raumteilen von Gasen sind bei gleichem Druck und gleicher Temperatur gleich viele Teilchen enthalten.

Josephe Louis Gay-Lussac (* 6.12.1778, † 09.05.1850)
Gesetz von J. G. Gay-Lussac (1778-1850)
- Bei der Herstellung von Wasser aus Wasserstoff und Sauerstoff reagieren jeweils 2 Raumteile Wasserstoffgas mit einem Raumteil Sauerstoffgas.
- Auch andere Gase nehmen an chemischen Reaktionen immer in einfachen, ganzzahligen Volumenverhältnissen teil.
- Auch Wasserstoff und Chlor verbinden sich zu je einem Raumteil miteinander, das Gewicht der Verbindung zeigt jedoch ein ganz anderes Verhältnis: 1 g Wasserstoff verbindet sich mit 35,5 g Chlor.
- Die chemische Gleichung: H2 + Cl2 → 2 HCl bedeutet also Dreierlei
(Ar von H = 1u; Ar von Cl = 35,5u):
- Wasserstoff und Chlor verbinden sich zu Chlorwasserstoff (Salzsäure)
- Ein Molekül Wasserstoff und ein Molekül Chlor verbinden sich zu zwei Molekülen Chlorwasserstoff
- Ein Mol (2 g) Wasserstoff und ein Mol Chlor (71 g) verbinden sich zu zwei Molen Chlorwasserstoff (2 x 36,5 g)
- Wenn gleiche Volumina verschiedener Gase gleich viele Teilchen enthalten, so müssen die Massen dieser Volumina im selben Verhältnis stehen wie die Massen der darin enthaltenen Teilchen
- Beispiel: unter Normalbedingungen
1 l Wasserstoff ~ 0,1 g (2g/22,4 l = 0,089g/l)
1 l Sauerstoff ~ 1,6 g (32g/22,4 l = 1,429 g/l)
Setzt man die Masse von Wasserstoff als 1u, so ergibt sich:
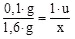
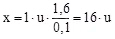
- Die absoluten Atommassen konnte man erst ermitteln, als es dem österreichischen Physiker Josef Loschmidt (1821-1895) gelang, die Anzahl der Teilchen in einem Gasvolumen zu bestimmen.
Er fand: 2 g Wasserstoff enthalten 6,022 x 1023 Moleküle - Die Anzahl von 602.300.000.000.000.000.000.000 Teilchen nennt man 1 Mol
- Zwischen der Avogadro-Konstante und der relativen Atommasseneinheit u besteht folgende Beziehung: 6,022 x 1023 u ergeben 1 Gramm.
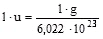
- Die Masse von 1 Mol Teilchen (Atome bzw. Moleküle) einer Substanz nennt man Molmasse. Sie entspricht zahlenmäßig der Atom- bzw. Molekülmasse.
- Ein Mol Teilchen eines Gases nimmt unter Normalbedingungen einen Raum von 22,4 l ein → Molvolumen